|
エイズ・HIV関連治療薬詳細情報 |
この文章は製薬会社から医師等に配布されている添付能書等をもとに制作されています
◆一般名:ザルシタビン、ジデオキシシチジン
◆商品名:ハイビッド
◆略 号:ddC
◆販 売:日本ロシュ株式会社
◆薬 価:1錠(0.375mg)およそ770円
◆用法用量:成人では1回2錠、1日3回、食後に内服
単剤、あるいはジドブジン(AZT)1回1Cap、1日3回との併用
![]() 医薬品ハイビッド錠0.375の承認及び薬価収載について(厚生省)
医薬品ハイビッド錠0.375の承認及び薬価収載について(厚生省)
ハイビッドは、米国国立癌研究所(NCI:National Cancer Institute)とHoffmann-La Roche社で開発された抗ヒト免疫不全ウイルス(HIV)薬である。本剤は、HIV逆転写酵素を阻害することにより、HIVの増殖を抑制する。
【組成】
本剤は、1錠中にザルシタビン0.375mgを含有する。
【効能・効果】
- 後天性免疫不全症候群(エイズ)
- 治療前のCD4リンパ球数500/mm3以下の症候性及び無症候性HIV感染症
【用法・用量】
- ザルシタビン単独療法
- 通常成人には、ザルシタビンとして1回0.75mgを1日3回、8時間ごとに口径投与する。
- ザルシタビンとジドブジンの併用療法
- 通常成人には、ザルシタビンとして1回0.75mgとともにジドブジン1回100mgを1日3回、8時間ごとに経口投与する。
|
【使用上の注意】
- 一般的注意
- 本剤の単独療法は、ジドブジンが効果不十分な場合又は副作用により使用不適当な場合のみ適用を考慮すること。
- 標準体重と比較して明らかに低い体重の患者には、少量から投与を開始することが望ましい。
- 本剤の使用に際しては、患者又はそれに代わる適切な者に、次の事項についてよく説明し理解させた後、使用すること。
- 本剤はHIV感染症の根治療法薬ではないことから、日和見感染を含むHIV感染症の進展に伴う疾病を発症し続ける可能性があるので、本剤投与開始後の身体状況の変化については、すべて担当医に報告すること。
- 本剤は動物実験で催奇形作用が報告されたいるので、妊娠の可能性のある婦人は、本剤の投与期間中は有効な避妊処置を行うこと。
- 膵炎、肝障害があらわれ重篤な転帰をとることがあるので、腹痛、悪心、嘔吐、黄疸等の症状があらわれた場合には、直ちに担当医に報告すること。
- 末梢神経障害(四肢末端のしびれ・灼熱感・刺通痛感等)があらわれることがあり、その発症は投与量に相関していると考えられるので、処方された用量を守ること。
- 膵炎があらわれることがあるので、定期的に血清アミラーゼ、血清リパーゼ等の生化学的検査を行うこと。これらの検査値の上昇がみられた場合には、投与を中止するなど適切な処置を行うこと。また、腹痛、悪心、嘔吐等の膵炎の発症を示唆する臨床症状がみられた場合には直ちに投与を中止し、生化学的検査(血清アミラーゼ、血清リパーゼ等)及び画像診断等による観察を行うこと。
- 本剤等のヌクレオシド類似体の投与により低酸素血症を伴わない乳酸アシドーシス、重度の脂肪肝があらわれることが報告されており、また本剤投与によりB型肝炎合併患者で肝不全が発現し死亡に至ったとの報告がある。肝機能障害のある患者に本剤を投与する場合には定期的に血清トランスアミナーゼ等の生化学的検査を行うなど、患者の状態を十分に観察し、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
- 口腔内潰瘍があらわれることがあるので、このような場合は投与を中止するなど適切な処置を行うこと。
- 食道潰瘍があらわれることがある。日和見感染に対する治療に反応しない食道潰瘍があらわれた場合は投与を中止するなど適切な処置を行うこと。
- 心筋症、うっ血性心不全があらわれることがあるので、基礎疾患に心筋症又はうっ血性心不全を有する患者やその既往歴のある患者には慎重に投与すること。
- アナフィラキシー反応があらわれることがあるので、このような場合には直ちに投与を中止し、適切な処置を行うこと。
- 禁忌(次の患者には投与しないこと)
- 本剤に対し過敏症の既往歴のある患者
- イセチオン酸ペンタミジンを投与中の患者[海外で本剤との併用により劇症膵炎のよる死亡例が報告されている。]
- 慎重投与(次の患者には慎重に投与すること)
- 末梢神経障害のある患者[症状を憎悪させるおそれがある。]
- 膵炎又はその既往歴のある患者[症状を憎悪又は再発させるおそれがある。]
- 肝機能障害、肝炎又はアルコール中毒歴のある患者[症状を憎悪させるおそれがある。]
- 腎機能障害のある患者[副作用が強くあらわれるおそれがある。]
- 心筋症、うっ血性心不全の患者、又はこれらの既往歴のある患者[症状を増悪又は再発させるおそれがある。]
- 相互作用
- 併用しないこと
イセチオン酸ペンタミジン[海外で本剤との併用により劇症膵炎による死亡例が報告されている]- 併用に注意すること
- コロラムフェニコール、シスプラチン、ジスルフィラム、エチオナミド、金製剤、ヒドララジン、イソニアジド、メトロニダゾール、フェニトイン、ビンクリスチン[末梢神経障害の発現する可能性が高くなるおそれがある。]
- アムホテリシンB、アミノグリコシド系製剤、プロベネシド、シメチジン[本剤の腎クリアランスを低下させ、末梢神経障害や他の副作用の発現を増加させるおそれがある。]
- マグネシウム又はアルミニウムを含有する制酸剤[本剤の吸収率を低下させるおそれがある。]
- ジダノシン[末梢神経障害、膵炎の発現する可能性が高くなるおそれがある。]
- 副作用(まれに:0.1%未満、ときに:0.1〜5%未満、副詞なし:5%以上又は頻度不明)
- 重大な副作用
次のような症状があらわれた場合には、投与を中止するなど適切な処置を行うこと。
- 末梢神経障害:四肢末端のしびれ・灼熱感・刺痛感等の末梢神経障害があらわれることがある。
- 精神神経系:自殺企図、てんかん発作、痙攣、失語症、麻痺、急性精神障害(幻覚、錯乱、妄想、昏迷等)、痴呆等があらわれることがある。
- 消化器:食道潰瘍があらわれることがある。
- 膵臓:膵炎(出血性)があらわれることがある。
- 肝臓:低酸素血症を伴わない乳酸アシドーシス、重度の脂肪肝、重篤な肝障害があらわれることがある。
- 循環器:心筋症、心不全、くも膜下出血があらわれることがある。
- 過敏症:アナフィラキシー反応があらあれることがある。
- 腎臓:急性腎不全があらわれることがある。
- 感覚器:聴力喪失があらわれることがある。
- その他の副作用
次のような副作用が認められた場合には、減量、休薬等の適切な処置を行うこと。
- 精神神経系:頭痛、ときにふらつき、緊張亢進、振戦、攣縮、運動失調、協調異常、言語障害、音声障害、多動、寡動、偏頭痛、神経痛、神経炎、眩暈、集中力低下、性欲減退、健忘、傾眠、抑うつ、不安、不眠、激越、神経過敏、躁状態、多幸症、隣人症等があらわれる。
- 消化器:口内炎(アフタ性、潰瘍性)、悪心、嘔吐、食欲不振、腹痛、下痢、ときに嚥下困難、消化管潰瘍、消化管出血、舌潰瘍、食道痛、歯肉疾患、口渇、唾液増加、唾液腺腫大、消化不良、鼓腸、腹部膨満感、おくび、便秘、大腸炎、直腸痛、肛門痛、痔疾、血便等があらあわれることがある。
- 膵臓:血清アミラーゼ値の上昇、血清リパーゼ値の上昇、トリグリセライド値の上昇、血清カルシウム値の減少等があらわれることがある。
- 肝臓:GOT上昇、GPT上昇、AI-P上昇、LDH上昇、ときに黄疸、肝炎、肝腫、胆嚢炎、γ-GTP上昇、AI-P減少等があらわれることがある。
- 循環器:ときに心悸亢進、不整脈、心房細動、頻脈、高血圧、失神等があらわれることがある。
- 過敏症:発疹、ときに掻痒、蕁麻疹、光線過敏症等があらわれることがある。
- 腎臓:ときに腎嚢胞、腎結石、BUN上昇、クレアチニン上昇、蛋白尿、排尿困難、尿閉、膀胱痛、頻尿、多尿等があらわれることがある。
- 呼吸器:咳、鼻炎、ときにチアノーゼ、咽頭炎、呼吸困難、喀血、胸部うっ血、副鼻腔炎、ラ音、喘鳴等があらわれることがある。
- 血液:貧血、白血球減少、好中球減少、MCV上昇、好酸球増多、また、ときに血小板減少、リンパ節症、鼻出血、紫斑、血栓、顆粒球増多、ヘモグロビン血症、好中球増多、血小板変化、白血球変化等があらわれることがある。
- 内分泌:血糖低下、血糖上昇、ときに痛風、高尿酸血症、低リン酸塩血症、多飲症等があらわれることがある。
- 皮膚:ときに皮膚炎、皮膚乾燥、脱毛、紅斑性発疹、ザ瘡、水疱性皮疹、フレグモーネ、口唇疱疹、膿疱性皮疹、カンジダ症、爪の異常、皮膚亀裂、皮膚潰瘍等があらわれることがある。
- 筋骨格:筋肉痛、また、ときに関節炎、関節痛、筋炎、四肢等の疼痛、骨痛、滑液包炎、筋脱力、CPK上昇等があらわれることがある。
- 感覚器:ときに眼球乾燥、視力異常、結膜炎、結膜変色、眼の異常(炎症、掻痒、疼痛、過敏、充血、出血、涙液増加等)、瞳孔調節障害、耳の障害(耳痛、耳鳴等)、味覚倒錯、味覚消失、嗅覚倒錯等があらわれることがある。
- 電解質異常:ときに高ナトリウム血症、低ナトリウム血症、高カリウム血症、低カリウム血症、低マグネシウム血症があらわれることがある。
- その他:発熱、悪寒、体重減少、疲労、倦怠、ときに無力症、全身浮腫、顔面痛、胸部痛、四肢冷感、インフルエンザ様症状、発汗、潮紅、悪液質、性器潰瘍・浮腫・掻痒・疼痛があらわれることがある。
- 高齢者への投与
一般に高齢者では生理機能が低下しているので減量するなど注意すること。- 妊婦への投与
動物実験(マウス、ラット)で以下の催奇形作用が報告されているので、妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断競れる場合にのみ投与すること。
- 生殖毒性試験(ラット)において、妊娠前から妊娠末期まで400mg/kg以上投与した群及び器官形成期に2,000mg/kg投与した群で胚の吸収率の増加及び催奇形性がみられたとの報告がある。また、妊娠末期から離乳まで1,000mg/kg投与した群の出生児に水頭症の発現と学習・記憶能が軽度の低下したとの報告がある。
- 生殖毒性試験(マウス)において、器官形成期に400mg/kg以上投与した群で胎児の体重減少及び催奇形性がみられたとの報告がある。
- 授乳婦への投与
動物実験(ラット)で乳汁中へ移行することが報告されているので、授乳婦に投与する場合には、授乳を中止させること。- 小児への投与
小児に対する安全性は確立していない(国内での使用経験はない)。- その他
変異原性試験で以下の報告がある。
ヒトリンパ球を用いた染色体異常試験において1.5μg/ml以上の用量で、マウスを用いた小核試験のおいて骨髄毒性を示す投与用量(4,500mg/kg)で、マウスBALB/c-3T3細胞を用いたトランスフォーメーション試験において125μg/ml以上で変異原性を示したとの報告がある。【薬効薬理】
- 作用機序
本薬は天然にあるDNA合成の構成成分の前駆体ヌクレオシド、2-デオキシシチジンの類体であり、ヒト免疫不全ウイルス(HIV)感染細胞内で細胞性酵素によりリン酸化され、活性型であるジデオキシシチジン-5-三リン酸体(ddCTP)になる。ddCTPはウイルスがRNAをDNAへ逆転写するために必須な逆転写酵素を拮抗的に阻害し、また、デオキシシチジン-5-三リン酸(dCTP)の代わりにウイルス新生DNA中に取り込まれ、ヌクレオチド3端の3-水酸基が欠失してDNA鎖伸長を停止することにより、ウイルスの増殖を阻害する。- 抗ウイルス作用
本薬はin vitroでヒトTリンパ球及びヒト単球/マクロファージにおけるHIVの複製を通常、0.01〜0.5μMで50%阻害(ID50)あるいは95%以上阻害(ID≧95)する。また、ヒトT細胞株ATH8及びMT4培養細胞を用いた系で、ウイルス感染させた細胞を50%防御する濃度(ID50)と非感染細胞(正常細胞)の生細胞数を50%減少させるのに要する濃度(TD50)の比を指標とした選択性指数(TD50/ID50)は175、120と良好な選択性を示した。- T細胞及び末梢血単球に対する影響
本薬はin vitroでHIVの正常ヒトT細胞に対する感染及び細胞変性作用阻害するのに必要な濃度の10〜20倍の濃度でも、正常ヒトT細胞のin vitro免疫反応性に対しほとんど影響を与えなかった。【体内薬物動態】
- 血中濃度
エイズ又はエイズ関連症候群(ARC)患者9例に本剤0.75mg(0.375mg×2)を1日3回(8時間間隔)長期経口投与したとき、本剤は速やかに吸収され、投与後平均1.1時間で最高血漿中濃度約15.5ng/mlを示し、半減期は約1.8時間(8例)であった。
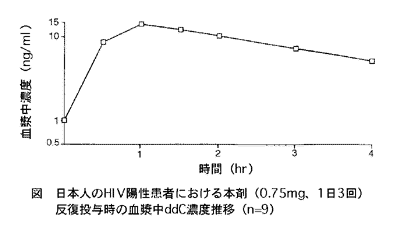
(参考)海外データ
エイズ又はエイズ関連症候群(ARC)患者20例に本剤1.5mg(0.375mg×4)を単回経口投与したとき、投与後平均0.8時間で最高血漿中濃度約25.2ng/mlを示し、半減期は約1.9時間であった。
- 分布
HIV陽性患者9例に本剤(0.06mg/kg又は0.09mg/kg)を4時間ごと、2週間静脈内投与したとき、2週間目の投与後2〜3.5時間での脳脊髄液濃度は血漿中濃度との比で0.09〜0.37(平均0.2)であった。
また、妊娠37〜42週での通常分娩又は帝王切開により得られた胎盤での本剤の移行を検討したところ、母側から胎盤へ単純拡散による速やかな移行が認められた。- 代謝・排泄
HIV陽性患者6例にC-サルシタビン(1.5mg)を経口投与したとき、投与後120時間までに投与量の76%が尿中に、7.8%が糞中に回収された。なお、そのほとんどは投与後24時間以内に排泄された。
また、HIV陽性患者4例にC-サルシタビン(1.5mg)を経口投与したとき、投与後48時間までに尿中に排泄された放射能の83%が未変化体ddC、11%が代謝物ddUであった。【臨床適用】
- 臨床試験成績
- 国内における臨床効果
国内においてサルシタビンの単独療法並びにジドブジンとの併用療法の2つの臨床試験を実施した。
- ザルシタビン単独療法
ジドブジンが無効、不耐容、投与不適格のエイズ又はエイズ関連症候群(ARC)患者24例を対象に、本剤1回0.75mgを1日3回8時間ごとに24週間投与した。その結果、有効性の評価が可能であった21例中、CD4リンパ球数が投与前値に比較し25/mm3かつ25%以上増加し、それが4週間以上持続した症例は1例(4.8%)、不変の状態を維持した症例は16例(76.2%)であった。また、17例(81.0%)は病勢の進行の指標である日和見感染・悪性新生物の発現がなかった。- ザルシタビンとジドブジンとの併用療法
CD4リンパ球数が100〜500/mm3のHIV感染症患者27例を対象に、本剤1回0.75mgとジドブジン1回100mgを1日3回8時間ごとに24週間投与した。その結果、有効性の評価が可能であった24例中、CD4リンパ球数が投与前値に比較し25/mm3かつ25%以上増加し、それが4週間以上持続した症例は12例(50%)、不変の状態を維持した症例は12例(50.0%)であった。また、21例(87.5%)は病勢の進行の指標である日和見感染・悪性新生物の発現がなかった。- 海外における臨床効果
海外におけるザルシタビン単独療法及びジドブジンとの併用療法の臨床試験の結果は、下記のとおりであり、本剤のHIV感染症患者に対する臨床上の有効性が確認された。
- ザルシタビンの単独療法試験
ジドブジン前治療歴が1年以上で、投与前CD4リンパ球数<200/mm3、13歳以上にエイズまたはARC患者59例を対象に、本剤1回0.75mgを1日3回52週間投与した。その結果、死亡あるいはエイズによる日和見感染・悪性新生物の発現を認めた症例は19例(32.2%)であった。死亡例数は10例(16.9%)であり、このうちエイズ患者は9例中2例(22.2%)、ARC患者は50例中8例(16.0%)であった。本剤投与による1年間の推定生存率は81%であった。
また、ジドブジンが無効、不耐容のエイズまたは投与前CD4リンパ球数≦300mm3、13歳以上のHIV感染症患者237例を対象に、本剤1回0.75mgを1にち3回投与した。その結果、病勢の進行(日和見感染、悪性新生物)例数と死亡例数は、それぞれ115例(48.5%)及び88例(37.1%)であり、1年間あたりの発現率及び死亡率は、それぞれ66.4/100人・年及び35.1/100人・年であった。- ザルシタビンとジドブジンの併用療法試験
18歳以上で、ジドブジン前治療歴のない投与前CD4リンパ球数≦200/mm3エイズ又はARC患者10例を対象に本剤1回0.01mg/kgとジドブジン1回100mgを1日3回投与した。その結果、有効性の評価が可能であった8例で投与後12週においてCD4リンパ球数の増加が7例認められ、そのうち4例は50/mm3以上の増加であった。
また、13歳以上で、ジドブジン前治療歴が24週以上、投与前CD4リンパ球数≦200/mm3の無症候性HIV感染症患者又は投与前CD4リンパ球数≦300/mm3の症候性HIV感染症患者423例を対象に、本剤1回0.75mgとジドブジン1回200mgを1日3回投与した。その結果、日和見感染や悪性新生物又は死亡に関する12ヵ月の推定無症候状率は73%であり、死亡例数は78例(18.4%)であった。また、併用療法におけるCD4リンパ球数の減少抑制効果、p24抗原量の減少効果は本剤単独療法に比較し、優れた成績を示した。(日本ではジドブジン600mg/日との併用は承認されていない。)- 副作用及び臨床検査値の変動
- 国内胃のザルシタビン単独療法及びザルシタビンとジドブジンとの併用療法試験における副作用及び臨床検査値の異常は下記のとおりであった。
- 副作用
単独療法において、安全性が評価可能であった23例における副作用は3例に5件認められ、口内炎(アフタ性、潰瘍性)2件、末梢神経障害、嚥下痛、発熱が各1件であった。
また、ジドブジンとの併用療法において、安全性が評価可能であった25例における副作用は3例に3件認められ、末梢神経障害が2件、胃潰瘍が1件であった。- 臨床検査値異常
単独療法における臨床検査値異常は23例中5例に8件認められ、GOT上昇、GPT上昇が各3件、血小板減少、好酸球増多が各1件であった。
また、ジドブジンとの併用療法における臨床検査値異常は25例中12例に24件認められ、赤血球減少5件、GOT上昇、GPT上昇が各4件、MCV上昇、LDH上昇が各3件、白血球減少2件、ヘモグロビン減少、ヘマトクリット減少、血清アミラーゼ上昇が各1件であった。- 海外のザルシタビン単独療法及びザルシタビンとジドブジンとの併用療法試験における副作用及び臨床検査値の異常は下記のとおりであった。
| 単独療法 | ジドブジンとの併用療法 | |||
| 米国臨床 第?/?相及び 拡大適用試験 |
米国臨床 第?相試験* |
米国小規模 臨床試験 |
米国臨床 第?相試験* |
|
| 評価対象症例数 | 4660例 | 285例 | 47例 | 423例 |
| 末梢神経障害 | 1079(23.2%) | 18(6.3%) | 13(27.7%) | 25(5.9%) |
| 頭痛 | 76(1.6%) | 5(1.8%) | 18(38.3%) | 25(5.9%) |
| めまい | 23(0.5%) | |||
| 潰瘍性口内炎 | 234(5.0%) | 11(3.9%) | 13(27.7%) | 4(0.9%) |
| 嘔気(悪心) | 109(2.3%) | 4(1.4%) | 17(36.2%) | 4(0.9%) |
| 嘔吐 | 33(0.7%) | 7(14.9%) | ||
| 食欲不振 | 23(0.5%) | 6(12.8%) | ||
| 嚥下困難 | 16(0.3%) | |||
| 心窩部痛 | 99(2.1%) | 4(1.4%) | 10(21.3%) | 7(1.7%) |
| 下痢 | 62(1.3%) | 1(0.4%) | 7(14.9%) | 6(1.4%) |
| 膵炎 | 78(1.7%) | 9(3.2%) | 8(1.9%) | |
| 皮疹 | 104(2.2%) | 6(2.1%) | 9(19.1%) | 6(1.4%) |
| 掻痒感 | 31(0.7%) | 7(14.9%) | ||
| 咽頭炎 | 14(0.3%) | 4(8.5%) | ||
| 筋痛 | 45(1.0%) | 7(14.9%) | 19(4.5%) | |
| 疲労感 | 62(1.3%) | 5(1.8%) | 17(36.2%) | 19(4.5%) |
| 発熱 | 8(0.2%) | 12(4.2%) | 17(4.0%) | |
| 筋脱力 | 9(0.2%) | |||
| 単独療法 | ジドブジンとの併用療法 | |||
| 米国臨床 第?/?相及び 拡大適用試験 |
米国臨床 第?相試験* |
米国小規模 臨床試験 |
米国臨床 第?相試験* |
|
| 評価対象症例数 | 4660例 | 285例 | 47例 | 423例 |
| 貧血 | 250(5.4%) | 13(4.6%) | 6(12.8%) | 35(8.3%) |
| 白血球減少 | 572(12.3%) | 4(8.5%) | ||
| 好中球減少 | 694(14.9%) | 26(9.1%) | 12(25.5%) | 82(19.4%) |
| 好酸球増多 | 193(4.1%) | 3(6.4%) | ||
| 血小板減少 | 185(4.0%) | 6(2.1%) | 3(6.4%) | 7(1.7%) |
| GOT上昇 | 209(4.5%) | 4(8.5%) | ||
| GPT上昇 | 227(4.9%) | 5(10.6%) | ||
| AI-P上昇 | 179(3.8%) | 2(4.3%) | ||
| γ-GTP上昇 | 8(2.8%) | |||
| 肝機能障害 | 24(0.5%) | 16(5.6%) | 25(5.9%) | |
| アミラーゼ上昇 | 9(0.2%) | 7(2.5%) | 6(1.4%) | |
【非臨床試験】
- 急性毒性(LD50値:mg/kg)
*:120時間持続点滴(mg/lg/時間)
動物 経口 静脈内 マウス 雄>4,000 雄>5,000 ラット 雌雄>2,000 イヌ 雌雄>3.53* - 亜急性・慢性毒性
- ラットにおいて、4週間経口投与試験(65、125、250、500mg/kg//日;1日1回投与)では変化は認められなかった。14週間経口投与試験(5、25、150、750mg/kg/日;1日1回投与)では高用量で軽度の貧血傾向が認められたが、52週間経口投与試験(20、150、1,000mg/kg日;1日1回投与)では高用量でも薬物の影響と考えられる変化は認められなかった。
- サルにおいて、4週間経口投与試験(50、100、200、400mg/kg/日;1日1回投与)では、造血障害に基づくと考えられる死亡例がめられ、白血球減少、化粧板減少と軽度の貧血の他、病理組織学的には、骨髄形成・出血、大腸粘膜の萎縮、胸腺の萎縮、脾臓のリンパ球枯渇等が認められ、無毒性量が求められなかった。52週間経口投与試験(0.1、1、4mg/kg/日;1日2回投与)では低・中用量では薬物の影響は認められず、高用量で体重増加抑制、GPT・GOTの軽度増加がみられたが、肝臓の病理組織所見では異常は認められなかった。なお、高用量では末梢神経障害(末梢神経伝導速度の減少、F波潜時の増加、近位運動神経伝導の減少)が観察されたが、13週間の休薬により回復傾向が認められた。
- イヌにおいて、4週間経口投与試験(8、40、200mg/kg/日;1日4回投与)及び13週間経口投与試験「5、30、200mg/kg/日;1日1回投与)では、高用量で造血障害に基づくと考えられる死亡例がみられたが、中用量では血液毒性は認められなかった。
- 生殖試験
- ラットにおける受胎能及び一般生殖能試験(1、50、400、2,000mg/kg/日;1日2回口径投与)では、親の受胎能及び一般生殖能に影響はなく、2高用量で吸収胚数の増加、胎児奇形が認められた。
- ラット及びマウスの期間形成期投与試験(ラット:1、50、400、2,000mg/kg/日、マウス:200、400、1,000、2,000mg/kg/日;各1日2回経口投与)では、ラットの最高用量で胎児体重減少、胎児奇形(眼開存、小下顎症、口蓋裂、小脳症)が、マウスの2高用量で胎児体重減少、奇形胎児(ラットの奇形と類似)が認められた。また、ラットの最高用量で出生児の生存率減少及び成長抑制が認められた。
- ラットの周産期及び授乳期投与試験(1、50、400、1,000mg/kg/日;1日2回経口投与)では、母獣に薬物の影響は認められず、出生児の成長及び生殖能に影響はなかったが、出生児の最高用量では水頭症多発し、学習・記憶能低下がみられた。なお、動物試験での1,000〜2,000mg/kg/日は、臨床用量(2.25mg/日=0.045mg/日)の約22,000〜44,000倍に相当する過剰用量である。
- 神経毒性
神経毒性試験においてウサギ18週間経口投与試験では、50mg/kg/日又は100mg/kg/日を約17週間経口投与した時に末梢神経障害(後肢麻痺、後肢知覚異常)が認められ、電気生理学的には末梢神経伝導速度及び振幅の減少、神経組織学的には末梢神経の変性(髄鞘分離・浮腫、軸索消失、脱髄)が認められた。サル38週間経口投与試験では、10mg/kg/日を19週間投与した時に明らかに電気生理学的変化(末梢神経伝導速度及び振幅の減少)あるいは神経組織学的変化(末梢神経の萎縮)が認められた。なお、ウサギ及びサルに中枢神経系の変化は認められなかった。- 変異原性試験
ネズミチフス菌を用いた復帰突然変異試験、チャイニーズハムスター肺細胞を用いた遺伝子突然変異試験及びラットの初代培養肝細胞を用いた不定期DNA合成試験においては変異原性は認められなかったが、ヒトリンパ球を用いた染色体異常試験及びマウスを用いた小核試験及びマウスのBALB/c-3T3細胞を用いたトランスフォーメーション試験では変異原性が陽性であった。- 抗原性試験
モルモットを用いた皮膚感作試験(Maximization Test法)及び皮膚光感作性試験(Harber法)において抗原性は認められなかった。【性 状】
- 製剤の性状
省略- 有効成分に関する理化学的知見
一般名:ザルシタビン(Zalcitabine)
略 名:ddC
化学名:(+)-2',3'-dideoxycytidine
構造式:
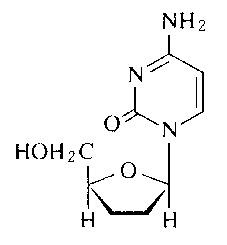
分子式:C9H13N3O3
分子量:211.22
性状:白色の微細な粉末。
水又はメタノールにやや溶けやすく、エタノールにやや
溶けにくく、アセトニトリルに溶けにくい。
融点:124〜126゜
【取扱い上の注意】
- 注 意
- 1.劇薬及び指定医薬品である
2.注意−医師等の処方せん・指示により使用すること- 貯 法
- しゃ光、室温保存、吸湿注意
- 使用期限
- 外箱に表示の使用期限内に使用すること
【包 装】 ハイビット錠0.375:100錠(ボトル)
【主要文献】
- Herdewijin P.et al.:J.Med.Chem.,30:1270,1987
- Cen M.S.et al.:Biochem.Pharmacol.,36(24):4361,1987
- Hao Z.et al.:Mol.Pharmacol.,34:431,1988
- Mitsuya H.et al.:Proc.Natl.Acad.Sci.USA84:2033,1989
- Richman D.D.et al.:Antimicrob.Agents Chemother.,31(12):1879,1987
- Balzarini j.et al.:Biochem.Pharmacol.37(14):2847,1988
- Mitsuya H.et al.:Proc.Natl.Acad.Sci.USA 83;1911,1986
- 島田 馨 他:化学療法の領域11:1802,1995
- Yarchoan R.et al.:Lancet1:76,1988
- Bawdon R.et al.:Am.J Obstet.Gynecol.167(6):1570,1992
- 島田 馨 他:化学療法の領域11:1983,1995
- Fischl M.A.et al.:Ann.Int.Med.118(10):762,1993
- Adrams D.I.et al.:New Engl.J.Med.330(10):657,1994
- Meng T.C.et al.:Ann.Int.Med.116(1):13,1992
- Fischl M.A.et al.:Ann.Int.Med.122(1):24,1995
- アメリカロシュ研究所 資料
- アメリカロシュ研究所 資料
- Lindstrom P.et al.:Teratology,42:131,1991
- Anderson T.D.et al.:Laboratory Investigation 66(1):63,1991
【文献請求先】 日本ロシュ株式会社 医薬品本部 医薬品情報センター
〒105 東京都港区芝2-6-1 FAX 03-5443-7112■製造・発売■
日本ロシュ株式会社
東京都港区芝2-6-1
米国ロシュ社ホームページへ
http://www.roche.com/