
 |
エイズ・HIV関連治療薬詳細情報
AZT/レトロビルカプセル
|
この文章は製薬会社から医師等に配布されている添付能書等をもとに制作されています
◆薬 価:1カプセル(100mg)381円
#1995年9月改訂(製薬協発第1445号)
*1995年2月改訂
日本標準商品分類番号87625
承認番号等
(62AM輪)297(薬価基準収載)
抗ウイルス化学療法剤
劇・指・要指レトロビル(R)レトロビルカプセル
<ジドブジンカプセル>
(別名:アジドチミジン,AZT)
Retrovir(R)Capsules
ジドブジンは、米国バローズウエルカム社で開発された抗ウイルス剤で強力な抗ヒト免疫不全ウイルス(HIV)作用を示す。HIV特有の逆転写酵素を阻害し、正常細胞への影響は少ない。本剤は、後天性免疫不全症候群(エイズ)及び治療前のCD4リンパ球数500/mm3以下の症候性及び無症候性HIV感染症の患者において、臨床的の有用性が認められている。なお、主な副作用は貧血及び白血球減少である。
【組成】
本剤は、1カプセル中にジドブジン100mgを含有する。
添加物として青色2号を含有する。
【効能又は効果】
- 後天性免疫不全症候群(エイズ)
- 治療前のCD4リンパ球数500/mm3以下の症候性及び無症候性HIV感染症
【用法及び用量】
- 後天性免疫不全症候群(エイズ)及び症候性HIV感染症
- 通常、成人には1回2カプセルを1日6回4時間毎に投与する。本剤投与開始後約1ヵ月目からは、1回1カプセルに減量することができる。なお、症状により適宜増滅する。
- 治療前のCD4リンパ球数500/mm3以下の無症候性HIV感染症
- 通常、成人には1回1カプセルを1日5回4時間毎(夜間を除く)に投与する。なお、症状により適宜増減する。
#【讐告】
本剤の投与により骨髄抑制があらわれるので、頻回に血液学
的検査を行うなど、患者の状態を十分に観察すること。 |
#【使用上の注意】
- 一般的注意
- 本剤の投与により骨髄抑制があらわれるので、投与開始後3カ月間は少なくとも2週間毎に血液学的検査を行い、その後は最低1カ月毎の検査を行うこと。
- 本剤投与中特に著しい好中球減少(750/mm3未満)又は著しい貧血(ヘモグロビン値が7.5g/dl未満)が認められた場合は、骨髄機能が回復するまで休薬する。これより軽度の貧血(ヘモグロビン値が7.5〜9.5g/d1)及び好中球減少(750〜1000/mm3)の場合は、滅量(1日3回投与等)する。著しい貧血がみられた場合、休薬及び減量を行っても輸血の必要な場合がある。
休薬又は減量後、骨髄機能が回復した場合には、血液学的所見及び患者の耐容性に応じて徐々に通常の投与量に増量する。
- 禁忌(次の患者には投与しないこと)
- 好中球数750/m m3未満又はヘモグロビン値が7.5g/dl未満の患者[好中球数、ヘモグロビン値が更に滅少することがある。]
- 本剤の成分に対し過敏症の既往歴のある患者
- イブプロフェン投与中の患者[出血傾向が増強したとの報告がある(「相互作用」の項参照)。]
- アセトアミノフェン及びアスピリン、インドメタシン等本剤のグルクロン酸抱合を競合的に阻害する可能性のある薬剤を投与中の患者[相互の毒性作用を増強するおそれがある(「相互作用」の項参照)。]
- 慎重投与(次の患者には慎重に投与すること)
- 好中球数1000/mm3未満又はヘモグロビン値が9.5g/d1未満の患者[好中球数、ヘモグロビン値が更に減少することがある。]
- 腎又は肝機能障害のある患者[高い血中濃度が持続するおそれがある。]
- ビタミンB12欠乏患者[貧血が発現するおそれがある。]
- 高齢者[「高齢者への投与」の項参照]
- 相互作用
- 併用しないこと
- 1)
- イブプロフェン[出血傾向が増強したとの報告がある。]
- 2)
- アセトアミノフェン及びアスピリン、インドメタシン等本剤のグルクロン酸包合を競合的に阻害する可能性のある薬剤[アセトアミノフェン併用期間中好中球数が減少したとの報告があり、相互の毒性作用を増強するおそれがある。]
- 併用に注意すること
- 1)
- ペンタミジン、ピリメタミン、スルファメトキサゾール・トリメトプリム合剤、フルシトシン、ガンシクロビル、インターフェロン、ビンクリスチン、ビンブラスチン、ドキソルビシン等腎毒性又は骨髄毒性を有する薬剤[本剤の毒性作用が増強されることがある。]
- 2)
- プロペネシド[本剤の全身クリアランスが約1/3に減少し半減期が約1.5倍延長したとの報告があるので、投与間隔を適宜あけること。]
- 3)
- フェニトイン[血中フェニトイン濃度に変動がみられたとの報告があるので、血中フェニトイン濃度を注意深く観察すること。]
- *4)
- フルコナゾール[本剤の血中濃度が上昇したとの報告がある。]
- 副作用(まれに:0.1%未満、ときに:0.1%〜5%未満、 副詞なし:5%以上又は頻度不明)
- 重大な副作用
- 1)
- 次のような症状が発現した場合には休薬すること。
垂篤な血液障害:汎血球減少、貧血、白血球減少、 好中球減少、血小板減少
なお、貧血の程度により輸血を行うこと。
- 2)
- 次のような症状があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
?うっ血性心不全
?乳酸アシドーシス
?てんかん様発作
- その他の副作用
- 1)
- 血液:貧血、白血球滅少、好中球減少、 血小板減少等があらわれることがあるので、このような場合には、減
量又は休薬すること。なお、貧血の程度により輸血を行うこと。
また、リンパ節腫脹があらわれることがある。
- 2)
- 全身症状:頭痛、無力症、発熱、倦怠感、悪寒、感冒症状、背痛、胸痛、疲労感等があらわれることがある。
- 3)
- 消化器:食欲不振、下痢、消化不良、腹痛、嘔気、嘔吐、便秘、嚥下困難、口唇浮腫、舌浮腫、あい気、鼓腸、歯肉出血、直腸出血、口内潰瘍等があらわれることがある。
- 4)
- 過敏症:発疹、座瘡、そう痒感、蕁麻疹等があらわれることがある。
- 5)
- 筋骨格:筋肉痛、ミオパシー、関節痛等があらわれることがある。
- 6)
- 精神神経系:眩暈、不眠症、手足のしびれ感、傾眠、不安感、感覚異常、錯乱、筋痙攣、振せん、攣縮、痛覚過敏、うつ状態、情緒不安、神経過敏症、失神、健忘症、見当識障害、嗄声、ストレス反応、空間の広がり感等があらわれることがある。
- 7)
- 呼吸器:呼吸困難、咳、鼻出血、咽頭炎、鼻炎、副鼻腔炎等があらわれることがある。
- 8)
- 泌尿器:無尿、多尿、頻尿、排尿障害、腎不全等があらわれることがある。
- 9)
- 肝臓:脂肪症を伴う肝腫、肝機能検査値の異常等があらわれることがある。
- 10)
- 循環器:血管拡張等があらわれることがある。
- 11)
- 皮膚:発汗、体臭変化、爪の色素沈着等があらわれることがある。
- 12)
- その他:味覚倒錯、弱視、難聴、羞明、霧視等があらわれることがある。
- 高齢者への投与
本剤は、主として肝臓で代謝され腎臓から排泄される(「体内薬物動態」の項参照)が、高齢者では肝機能又は腎機能が低下していることが多いため高い血中濃度が持続するおそれがあるので、患者の状態を観察しながら慎重に投与すること。
- 妊婦・授乳婦への投与
- 動物実験で胎仔毒性(胎仔吸収率の増加)が報告されているので、妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
- 動物実験で乳汁への移行が報告されているので本剤服用中は授乳を避けさせること。
- 小児への投与
小児における安全性及び有効性は確立されていないので、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
- その他
がん原性試験(マウス、ラット、経口高用量)で試験末期に雌動物に膣腫瘍が発生したとの報告がある。
【薬効薬理】
- 作用機序1)
ジドプジン(AZT)はヒト免疫不全ウイルス感染細胞内で、細胞性酵素によりリン酸化され、活性型の3リン酸体(AZTTP)となる。AZTTPはウイルス逆転写酵素を競合的に阻害し、またデオキシチミジン3リン酸の代りにウィルスDNA中に取り込まれて、DNA鎖伸長を停止することによりウィルスの増殖を阻害する。AZTTPのウイルス逆転写酵素に対する親和性は、細胞性DNAポリメラーゼより約100倍強いので、正常細胞に比し、選択性の高い抗ウイルス作用を示す(ヒトリンパ球系H9細胞増殖に対するin vitroでのID50値は267ug/ml)。
- 抗ウイルス作用
- ジドブジンのヒト免疫不全ウイルスの対するin vitroにおけるID50値は、CD4リンパ球系細胞を用いた系では0.13ug/ml以下であった2)。
- マウスにマウスレトロウイルス(Rauscherマウス白血病ウイルス)を接種し、接種4時間目より、ジドブジンを1.0mg/mlの割合で飲用水に混入して投与した実験では、平均脾臓重量、脾臓細胞感染率、及び血中ウイルス力価が対照群に比し著しく低下した。また感染後生存日数も延長した3)。
【体内薬物動態】4)(参考)注)
- 血中動態
エイズ又はエイズ関連症候群(ARC)患者に2.0〜15mg/kgを経口投与時の最高血漿中濃度は0.5〜14.4ug/mlを示し、平均血漿中半減期は約1時間であった。また、250mgカプセル(3.0〜5.4mg/kg)を4時間毎に長期経口投与時の定常状態における谷時及び投与1.5時間後における血清中濃度はそれぞれ0.16±0.17ug/ml及び0.62±0.31ug/mlであった。
- 分布
髄液中への移行が認められ、2mg/kg経口投与1.8時間後におけるジドブジンの髄液中/血漿中濃度は0.15であり、2.5及び5.0mg/kg静脈内投与2〜4時間後の髄液中/血漿中濃度比はそれぞれ0.20及び0.64であった。
- 代謝・排泄
ヒトでの主代謝物はグルクロン酸包合体(3'-azido-3'-deoxy-5'-glucuronyl-thymidine)であった。エイズまたはARC患者に2〜10mg/kgを経口投与時の未変化体及びグルクロン酸包合体の平均尿中回収率は、それぞれ14,3%及び75,3%であった。
注)外国人による成績である。
【臨床適用】5)〜8)(参考)注)
<国内使用成績調査における成績>
総症例157例中、副作用が報告されたのは、76例(48,41%)であり、主な副作用は貧血、大球性貧血等の赤血球障害36例(22.93%)、白血球減少、顆粒球減少等の白血球・網内系障害29例(18.47%)、嘔気、食欲不振、腹痛等の消化管障害29例(18.47%)であった。
日本人における臨床試験はまだ例数が少ないため、参考までに米国での臨床試験結果を以下に記す。
なお、投与前CD4リンパ球数500/mm3以上のHIV感染患者については、有効性及び安全性は確認されていない。
<米国において実施されたプラセボ対照二重盲検比較試験の成績>
- エイズ患者160例又はARC患者122例、総計282例を対象とした比較試験(ジドブジン群145例、プラセボ群137例)において、ジブビジン1回250mg又はプラセボを1日6回4時間毎、8〜24週間投与した。その結果、死亡者数(シドブジン群vsプラセボ群:1例vs19例)、24週目における推定生存率(98%xs78%)、日和見感染発症例数(24例vs45例)、24週目における日和見感染推定発現率(23%vs43%)、カポジ肉腫発症例数(6例vs10例)、Ksrnofsky performance scores(第12週目1.3増加vs5.2
減少)、体重(第16週目2.0kg増加vs1.3kg減少)、CD4リンパ球数(第12週目)、遅延型皮膚反応陽転率(29%vs9%)等に有効性を認めた。
- 本比較試験において最も頻度の高い臨床検査値異常は、貧血(ヘモグロビン値7.5g/dl未満)、白血球減少及び好中球減少であった。ジドブジンぐんのうち9例(34%)は減量又は休薬が行なわれ、又45例(31%)は少なくとも1回以上の輸血を必要とした。この血液学的異常所見は、投与開始時のCD4リンパ球数の低い症例に、より頻度が高かった。投与開始時のCD4リンパ球数による貧血及び好中球減少の発現率を表-1に示す。
表-1貧血及び好中球減少発現症例数 ( ):%
| CD4投与前値 |
| ≦100/mm3 | 101〜499/mm3 |
ジドブジン群
(n=91) | プラセボ群
(n=88) | ジドブジン群
(n=52) | プラセボ群
(n=47) |
| 貧血 | Hgb<7.5g/dl | 29(31.9) | 5(5.7) | 6(11.5) | 1(2.1) |
| Hgb<6.5g-dl | 15(16.5) | 1(1.1) | 3(5.8) | 1(2.1) |
| 好中球数 | >1000/mm3 | 29(31.9) | 66(75.0) | 36(69.2) | 40(85.1) |
| 750〜1000/mm3 | 16(17.6) | 13(14.8) | 6(11.5) | 6(12.8) |
| 500〜749/mm3 | 25(27.5) | 7(8.0) | 8(15.4) | 0 |
| <500/mm3 | 21(23.1) | 2(2.3) | 2(3.8) | 1(2.1) |
ジドブジン投与患者のうち5%以上に発現した副作用(表-2)で優位に発現率の高いものは、嘔気、不眠症及び筋肉痛であった。
表-2 副作用発現症例数 ( ):%
| ジドブジン群(n=145) | プラセボ群
(n=137) | | ジドブジン群(n=145) | プラセボ群
(n=137) |
全身症状
無力症
発熱
頭痛
倦怠感
消化器系
食欲不振
下痢
腹痛
嘔気 |
27(19)
23(16)
61(42)
11(8>
16(11)
18(12)
25(17)
66(46) |
25(18)
16(12)
51(37)
9(7)
11(8)
25(18)
20(15)
25(18) | 筋骨格系
筋肉痛
神経系
めまい
不眠症
傾眠
皮膚
発疹
特殊感覚
味覚等錯 |
11(8)
8(6)
7(5)
11(8)
24(17)
7(5) |
3(2)
6(4)
1(1)
12(9)
21(15)
11(8) |
- 初期症候性HIV感染患者(投与前CD4リンパ球数200〜800/mm3)713例を対象とした比較試験(ジドブジン群361例、プラセボ群352例)において、ジドブジン1回200mg又はプラセボ1日6回4時間毎薬1ヵ月投与した。その結果、投与前CD4リンパ球数500/mm3以下の患者(ジドブジン群261例、プラセボ群254例)では重傷ARC、エイズ又は死亡への進行率(ジドブジン群vsプラセボ群:4.6%vs13.4%)に有効性を認め、またCD4リンパ球数、血清中p24抗原量及び体重にも効果がみられた。
- 本比較試験における貧血及び好中球数減少の発現率を表-3に示す。
表-3 貧血及び好中球減少発現症例数
(CD4投与前値200〜800/mm3)( ):%
| ジドブジン群
(n=361) | プラセボ群
(n=352) |
| 貧血 | Hgb<8g/dl | 13(3.6) | 0 |
| 好中球数 | <750/mm3 | 14(4.2) | 5(1.4) |
本試験においてジドブジン投与患者で有意に発現率の高い副作用は、無力症、消化不良、嘔気、嘔吐であった。
- 無症候性HIV感染患者(投与前CD4リンパ球数500/ mm3以下)1338例を対象とした比較試験(ジドブジン1回500mg/日群453例、同1500mg/日群457例、プラセボ群428例)おいて、ジドブジン1回100mg又は300mg又はプラセボを1日5回4時間毎(夜間を除く)41〜52週投与した。その結果、両ジドブジン群において重症ARC又はエイズへの進行率(ジドブジン500mg/日群、同1500mg/日群、プラセボ群:3.8%vs4.2%vs8.9%)に有効性を認め、またCD4リンパ球数及び血清中p24抗原量にも効果がみられた。
- 本比較試験における貧血及び好中球減少の発現率を表-4に示す。
表-4 貧血及び好中球減少発現症例数
(CD4投与前値500/mm3以下) ( ):%
| ジドブジン
500mg/日群
(n=453) | ジドブジン
1500mg/日群
(n=457) | プラセボ群
(n=428) |
| 貧血 | Hgb<8g/dl | 5(1.1) | 29(6.4) | 1(0.2) |
| 好中球数 | <750/mm3 | 8(1.8) | 29(6.4) | 7(1.6) |
本試験においてジドブジンの両群又はどちらか一方の群で有意に発現率の高い副作用は無力症、頭痛、倦怠感、食欲不振、便秘、嘔気、嘔吐、めまいであった。
注)外国人よる成績である。
【非臨床試験】9)
- 毒性
- 急性毒性(LD50値, mg/kg)
| 投与経路 | 静脈内 | 経口 |
| 動物 | ♂ | ♀ | ♂ | ♀ |
マウス
ラット | >750
>750 | >750
>750 | 3568
3084 | 3062
3683 |
- 亜急性・慢性毒性
- 1)
- ラットにおける経口投与3ヵ月試験(56,167,500mg/kg/day,1日2回投与)では異常は認められなかった。6ヵ月試験(50,150,500mg/kg/day,1日2回投与)の高用量群及び12ヵ月試験(50,150,450mg/kg/day,1日2回投与)の中及び高用量群に貧血が認められたが休薬により回復した。
- 2)
- サルにおける経口投与3ヵ月試験、6ヵ月試験及び12ヵ月試験(いずれも35,100,300mg/kg/day,1日2回投与)では前投与群に貧血が認められたが休薬により回復した。
- 生殖試験
- 1)
- ラット及びウサギの器官形成期に投与を行った催奇形性試験(ラット125,250,500mg/kg/day,ウサギ50,150,500mg/kg/day,1日2回投与)では、催奇形作用は認められなかった。
- 2)
- ラットの受胎能及び一般生殖能試験(50,150,450mg/kg/day,1日2回投与)では、中及び高用量群に胎仔吸収率の増加、高用量群に胎仔平均体重の減少がみられた。ラットの周産期及び授乳期試験では、異常所見は認められなかった。
- がん原性試験
マウス(20,30,40mg/kg/day,1日1回経口投与)及びラット(80,220,300mg/kg/day,1日1回経口投与)における試験では、雄動物で試験末期に膣扁平上皮細胞癌(マウス高用量群5/60、ラット高用量群2/60)が認められた。
- 分布
ラットに10mg/kgを経口投与した組織分布試験では、各組織に広範な分布が認められた。特に胃、腸、腎で高い組織中濃度を示し、脳ヘの移行もみとめられた。
妊娠ラット及び妊娠ウサギに経口投与した場合には、胎仔移行も認められた。
【性 状】
- 製剤の性状
省略
- 有効成分に関する理化学的知見
一般名:ジドブジン(Zidovudine)
化学名:3'-アジド-3'デオキシチミジン
分子式:C10H13N5O4
分子量:267.24
構造式:
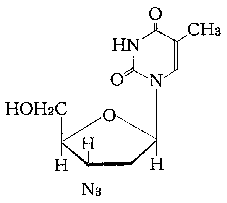 性状:白色〜微黄白色の粉末で、においはない。
性状:白色〜微黄白色の粉末で、においはない。
エタノールにやや溶けやすく、水にやや溶けにくい。
光によって分解する。
融点:124〜126゜
【取扱い上の注意】
- <注意>
- 1.注意ー医師等の処方せん・指示により使用すること。
2.本剤は劇薬、指定医薬品である。
- <貯法>
- 遮熱した気密陽気、室温保存
- <使用期限>
- 組箱、ラベルに記載
【包 装】
100カプセル瓶
【主要文献及び文献請求先】
<主要文献>
- 1)
- P.A.Furman et al.:Proc.Natl.Acad.Sci.USA.,83(21),8333-8337(1986)
- 2)
- H.Mitsuya et al.:Proc.Natl.Acad.Sci.USA.,82(20),7096-7100(1985)
- 3)
- R.M.Ruprecht et al.:Nature,323(6087),467-469(1986)
- 4)
- R.Yarchoan.:Lancet,1(8481),575-580(1986)
- 5)
- M.A.fischl et al.:N.Engl.J.Med.,317(4),185-191(1987)
- 6)
- D.D.Richman et al.:N.Engl.J.Med.,317(4),192-197(1987)
- 7)
- M.A.Fischl et al.:Ann.Intern.Med.,112(10),727-737(1990)
- 8)
- P.A.Volberding et al.:N.Engl.J.med.,322(14)941-949(1990)
- 9)
- K.M.Ayers et al.:Am.J.Med.,85(Srppl.2A),186-188(1988)
<文献請求先>
日本ウエルカム株式会社 医薬情報部〒650 神戸市中央区東川崎町一丁目1番3号
■輸入発売元■
日本ウエルカム株式会社
〒650 神戸市中央区東川崎町一丁目1番3号
■販売元■
住友製薬株式会社
〒541 大阪府中央区道修町2丁目2番8号
 グラクソウエルカム社ホームページへ
グラクソウエルカム社ホームページへ
http://www.glaxowellcome.co.uk/
 エイズ・HIV関連治療薬情報メニューに戻る
エイズ・HIV関連治療薬情報メニューに戻る

![]() グラクソウエルカム社ホームページへ
グラクソウエルカム社ホームページへ